病原性 CD4 陽性 T 細胞に発現するマイクロRNAがケモカイン受容体の発現を制御し、自己免疫疾患発症に関与
細胞に発現するマイクロRNAがケモカイン受容体の発現を制御し、自己免疫疾患発症に関与 新規治療薬開発に期待 【研究の概要】
国立研究開発法人医薬基盤・健康・栄養研究所(大阪府茨木市、理事長:中村祐輔)生体機能分子制御プロジェクト・サブプロジェクトリーダーの飯島則文らは、独立行政法人国立病院機構北海道医療センター臨床研究部長の新野正明、国立大学法人大阪大学大学院歯学研究科バイオインフォマティクス研究ユニットリーダー/准教授の山口雅也、同大学院医学系研究科や国立大学法人東京大学医科学研究所と共同で、実験的自己免疫疾患が誘導される条件で活性化する、自己の細胞を攻撃し、さまざまな疾病を引き起こす
病原性 CD4 陽性 T 細胞1(CXCR6陽性、SLAMF62陰性) にのみマイクロ RNA3の一種である 『miR-147-3p』 が高発現し、このマイクロ
RNA が『CXCR3』などのケモカイン受容体4の発現を制御することにより、自己免疫疾患の病態発現に大きく影響を与えることを発見しました。※マイクロ
RNAは、タンパク質を合成する情報を持っていませんが、mRNA
からのタンパク質合成を抑制または調節することでさまざまな生理機能の維持に重要な役割を果たすことが明らかになってきており、『マイクロ RNAの発見』が、2024
年のノーベル生理学・医学賞の受賞対象となりました。【研究成果のポイント】◆神経細胞の軸索に発現する自己抗原+結核菌死菌5+不完全フロイントアジュバント6
(Incomplete Freund’s Adjuvant: IFA)を接種したマウスの所属リンパ節で、自己反応性CD4 陽性 T 細胞がマイクロ
RNA『miR-147-3p』を高発現していることを発見しました。◆同マウスではまた、脳組織に浸潤する活性化CD4 陽性 T 細胞群
(CXCR6陽性・SLAMF6陰性、CXCR6陽性・SLAMF6陽性及びCXCR6陰性・SLAMF6陽性)のうち、自己の細胞を攻撃し、さまざまな疾病を引き起こすと考えられる
病原性を有するCXCR6陽性・SLAMF6陰性細胞群においてのみ、マイクロRNA『miR-147-3p』が高発現することを発見しました。
◆(CRISPR/Cas9 システムを用いた)遺伝子編集7により病原性 CD4 陽性 T 細胞に発現する
マイクロRNA『miR-147-3p』の発現を抑制すると、ケモカイン受容体『CXCR3』の発現が上昇し、自己免疫疾患の発症を抑制
できました。(すなわち、マイクロRNA『miR-147-3p』の抑制が自己免疫疾患の改善に寄与する可能性が示唆されました。)【今後、期待されること】今後、病原性
CD4 陽性 T 細胞に発現するマイクロRNA『miR-147-3p』が ケモカイン受容体『CXCR3』を制御するメカニズムを解明することで、
マイクロRNA『miR-147-3p』を標的とした自己免疫疾患に対する新たな治療薬の開発に繋がることが期待されます。
本研究成果は2024年10月11日に『Journal of Autoimmunity』にオンライン掲載されました。ウェブサイト:
https://doi.org/10.1016/j.jaut.2024.103319研究の背景と意義
自己免疫疾患は、自己抗原に反応する制御不能な免疫系が特定の組織を破壊し、重篤な障害を引き起こす病的状態であり、その発症率は年々増加しています。性別、遺伝、肥満、喫煙、有害物質への曝露、特定の薬剤、感染症などの潜在的な危険因子が予測されていますが、自己免疫疾患を引き起こす根本的な原因や正確なメカニズムは、依然として不明です。
臓器特異的な自己免疫疾患として、多発性硬化症や慢性関節リウマチ、バセドウ病、潰瘍性大腸炎、クローン病などが知られていますが、それぞれの組織に発現する抗原を認識する
CD4 陽性 T 細胞の活性化が検出されており、組織に傷害を与えるT 細胞として病原性 T 細胞と呼ばれています。このような自己反応性 T
細胞がどのようにして活性化するのか、詳細なメカニズムは依然として不明です。そのため、病原性 T 細胞がどのようにして分化するのか、病原性 T
細胞に特徴的に発現する分子の探索を介して、自己免疫疾患の治療標的を明確にすることを目的としました。本研究の内容
自己免疫疾患を誘導する実験動物モデルでは、自己に発現する抗原を、結核菌死菌とIFAという2種類のアジュバントと組み合わせて実験動物に接種すると、さまざまな自己免疫疾患を誘導できることが知られています。今回、主に自己抗原としてミエリンオリゴデンドロサイト糖タンパク質(Myelin
Oligodendrocyte Glycoprotein:MOG)を選択し、MOG+結核菌死菌+IFA
をマウスに接種して多発性硬化症と同様の症状が再現できる実験的脳脊髄炎モデルを用いて、病原性 CD4 陽性 T 細胞の分化や病原性 CD4 陽性 T
細胞に特異的に発現する遺伝子・分子の探索を行いました。先行研究では、結核菌の死菌と自己抗原だけでは自己免疫疾患が誘導されず、IFA
と共に接種することで、自己免疫疾患の症状が誘発されることを発見しましたa。そこで、まず IFA
の添加がどのようにして自己免疫を活性化させるのか、そのメカニズムの解明を目指しました。最初に、IFA の添加により、病原性を有する自己反応性CD4 陽性 T
細胞に発現する細胞群 (CXCR6 陽性及び SLAMF6 陰性)の割合が、所属リンパ節で増大していること見出しました。次に、その所属リンパ節で、IFA
を添加した場合としない場合で、所属リンパ節の自己反応性CD4 陽性 T 細胞に発現する遺伝子群を解析したところ、IFA を添加した場合にこれらのCD4 陽性 T
細胞でマイクロ RNA、miR-147-3pが高発現することを明らかにしました。加えて、神経組織に侵入するCD4 陽性 T
細胞群を解析したところ、病原性の高いCD4 陽性 T 細胞群 (CXCR6 陽性及び SLAMF6
陰性)にmiR-147-3pが高発現していることがわかりました。さらには、CRISPR/Cas9 システムによる遺伝子編集により自己反応性特異的CD4 陽性 T
細胞のmiR-147-3p 発現を抑制すると、自己免疫疾患の誘導が抑制されました。そこで、病原性 CD4 陽性 T 細胞に発現するmiR-147-3p
の作用機序を詳細に解析したところ、miR-147-3p はCD4 陽性 T 細胞の分化には影響せず、病原性CD4 陽性 T 細胞 (CXCR6 陽性及び
SLAMF6 陰性) に発現するケモカイン受容体 CXCR3 の発現を抑制することが明らかとなりました。多発性硬化症の患者の脳実質組織ではCXCL16
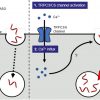
(CXCR6 のリガンド)の分泌が亢進しており、そのため血中からCXCR6 を発現する病原性 CD4 陽性 T
細胞が脳実質組織へ遊走し、神経細胞が傷害されます(図1)。 多発性硬化症の患者では、血液脳関門に局在する脳血管内皮細胞で、CXCL9(CXCR3
のリガンド)の発現亢進が認められていますが(図1)、miR-147-3pによってCXCR3の発現が抑制されている病原性 CD4 陽性 T
細胞はCXCL9の作用を受けないので脳血管周囲に滞留することなく、脳実質組織に浸潤して神経細胞を障害します。このようなメカニズムは、多発性硬化症に限らず、他の自己免疫疾患の病態にも関与していると考えられ、病原性
CD4 陽性 T 細胞に発現するmiR-147-3p を標的とした新規自己免疫疾患治療方法が確立されることが期待できます。

図1. 病原性の高い自己反応性 CD4 陽性 T 細胞 (CXCR6 陽性及び SLAMF6 陰性)が miR-147-3p を発現し、ケモカイン受容体
CXCR3 の発現を抑制し、病原性を発揮する。研究支援本研究は、科学研究費助成事業挑戦的研究(開拓)における研究課題「T
細胞による神経活動制御機構の解明」、国立研究開発法人日本医療研究開発機構(AMED)感染症研究革新イニシアティブ(J-PRIDE)事業における研究課題「組織局在型メモリー
T 細胞に着目した潜伏感染ウイルスの再活性化機構の解明」及び公益財団法人 大樹生命厚生財団
第53回医学研究助成における研究課題「神経変性疾患を引き起こす自己反応性活性化 T
細胞の分化誘導機構とその機能の解明」を中心に、国立研究開発法人日本医療研究開発機構(AMED)ワクチン・新規モダリティ研究開発事業、持田記念医薬薬学振興財団及び内藤記念科学振興財団等の支援を受けて遂行されました。
論文情報論文タイトル:miR-147-3p in pathogenic CD4 T cells controls chemokine receptor
expression for the development of experimental autoimmune diseases著者:Norifumi
Iijima1*§,, Masaya Yamaguchi2,3,4,5, Tomoya Hayashi6, Yuxiang Rui, Yuta Ohira7,
Yoichi Miyamoto1, Masaaki Niino8, Tatsusada Okuno9, Osamu Suzuki10, Masahiro
Oka11 and Ken J Ishii6*(*責任著者、§,代表連絡先)1. 国立研究開発法人医薬基盤・健康・栄養研究所 創薬デザイン研究センター
生体機能分子制御プロジェクト2. 国立大学法人大阪大学大学院歯学研究科 バイオインフォマティクス研究ユニット3. 国立大学法人大阪大学
微生物病研究所附属バイオインフォマティクスセンター4. 国立大学法人大阪大学大学院歯学研究科 微生物学講座5. 国立大学法人大阪大学 感染症総合研究教育拠点6.
国立大学法人東京大学 医科学研究所ワクチン科学分野7. ゼリア新薬工業株式会社 中央研究所医薬開発研究部8. 国立病院機構北海道医療センター 脳神経内科
臨床研究部9. 国立大学法人大阪大学大学院医学系研究科 神経内科学講座10. 国立研究開発法人医薬基盤・健康・栄養研究所
創薬資源研究支援センター疾患モデル小動物研究室11. 国立大学法人大阪大学 微生物病研究所掲載雑誌:Journal of Autoimmunity参考情報a.
https://www.nibiohn.go.jp/information/nibio/2024/09/009299.html用語解説1. CD4 陽性 T
細胞:CD4 陽性 T 細胞は、細胞表面に CD4 と T 細胞受容体を発現する細胞であり、樹状細胞などの抗原提示細胞に発現する主要組織適合遺伝子複合体
(Major Histocompatibility Complex:MHC) クラス II に提示される抗原を認識することができる。抗原を認識した CD4 陽性
T 細胞は活性化し、さまざまなサイトカイン (IFN-g, IL-17A, GM-CSF, IL-4や IL-13 など)
や細胞障害活性因子(グランザイムなど)を分泌する。IFN-g, IL-17A または IL-4 などのサイトカインは、それぞれマクロファージの活性化、ケモカイン
CXCL2 の分泌亢進またはB 細胞の活性化などを誘導し、ヘルパー機能を有する。また、IFN-g
などは、病原体が感染した細胞に直接作用し、病原体を除去するエフェクター機能も有する。2. SLAMF6:シグナル伝達リンパ球活性化分子(Signaling
Lymphocytic Activation Molecule:
SLAM)ファミリーに属する免疫受容体のひとつであり、自然免疫及び獲得免疫の両方における制御分子として機能することが知られている。3. マイクロ RNA:
高等生物の細胞や組織の中には、さまざまな機能を司るタンパク質をコードするRNA(メッセンジャーRNA)とは異なり、タンパク質合成に関与していないと考えられるnon-coding
RNA
(ncRNA:非コードRNA)が多数存在する。これらのなかには、マイクロRNA(miRNA)と呼ばれる21~23塩基ほどの長さの一本鎖の短鎖RNAがあり、発生や細胞分化の過程に重要な役割を果たすことが知られていたが、さまざまな疾患においても重要な役割を果たすことが明らかにされつつある。
4. ケモカイン受容体:ケモカイン受容体は、ヘテロ三量体 G
タンパク質に共役した7回膜貫通型受容体であり、そのリガンドであるケモカインと相互作用し、活性化される。現時点ではケモカイン受容体は19種類が同定されており、一つの受容体が複数のケモカインと結合可能である。ケモカイン受容体サブファミリーは、CXCR、CCR、(X)CR、CX3CRなどに分類される。
5. 結核菌死菌:結核菌 H37Ra 株を加熱滅菌した製剤。結核菌に発現する細胞壁の糖脂質 TDM、リポタンパク質やリポマンナンなどが、抗原提示細胞に発現するC
型レクチン受容体 Mincle や TLR2 によって認識され、炎症に関わる転写因子の活性化が誘導される。6. アジュバント:
アジュバントは、ワクチンと一緒に投与して、目的とする免疫応答の誘導を強化するために使用される物質のこと。一般的な弱毒化生ワクチンや不活化ワクチンには、免疫応答を活性化する病原体の構成成分や核酸が含まれているので、アジュバントを添加しなくても強い免疫反応を誘導することが可能である。病原体由来のタンパク質やペプチドを用いたワクチンを接種する場合は、強い免疫応答を誘導するためにアジュバントを必要とする。
不完全フロイントアジュバントは、ミネラルオイルと界面活性剤であるモノオレイン酸マンニドとの混合物であり、結核菌死菌と不完全フロイントアジュバントの組み合わせは、完全フロイントアジュバントと呼ばれている。完全フロイントアジュバントに自己抗原としてミエリン抗原、2型コラーゲンまたは網膜S抗原などを加えて実験動物に接種することで、それぞれ異なる実験的自己免疫疾患の誘導が可能である。
7. CRISPR/Cas9 システムを用いた遺伝子編集:
CRISPR-Cas9(クリスパー・キャスナイン)とは、DNAの二本鎖切断を原理とする遺伝子改変ツールであり、主に遺伝子の機能欠損(ノックアウト)のために使われる。CRISPR-Cas9は、ガイドRNA(gRNA)と、ヌクレアーゼであるCas9から構成される。gRNAは、標的とするDNA配列を特異的に認識して結合し、Cas9をその結合部位に導く。そして、Cas9がDNAの二本鎖を切断することになる。
医薬基盤・健康・栄養研究所について
2015年4月1日に医薬基盤研究所と国立健康・栄養研究所が統合し、設立されました。本研究所は、メディカルからヘルスサイエンスまでの幅広い研究を特⾧としており、我が国における科学技術の水準の向上を通じた国民経済の健全な発展その他の公益に資するため、研究開発の最大限の成果を確保することを目的とした国立研究開発法人として位置づけられています。
ウェブサイト:https://www.nibiohn.go.jp/

当リリースの詳細について
https://prtimes.jp/main/html/rd/p/000000061.000118477.html
※このメールは自動送信されていますので、返信はご遠慮ください。



ディスカッション
コメント一覧
まだ、コメントがありません