食物アレルギー治療成功のカギを解明 ~アレルギーを引き起こす悪玉細胞が抑制する善玉細胞へと切り替わる~
~アレルギーを引き起こす悪玉細胞が抑制する善玉細胞へと切り替わる~ 千葉大学大学院医学研究院・倉島洋介准教授、 東京大学医科学研究所・清野宏教授、
高里良宏医師の研究グループは、 食物アレルギーの唯一の治療法でありながら、
その機序についていまだ不明な点が多かった経口免疫療法(注1)の治療メカニズムの一端を解明しました。
本研究では、 アレルギーの発症の原因である「悪玉」免疫細胞の一つ、 マスト細胞(注2)が、
治療が成功している場合にはアレルギーを抑える働きをする「善玉」細胞へと切り替わっていることが、 マウスを用いた実験により明らかになりました。 本発見をもとに、
悪玉細胞を善玉細胞へと効率的に切り替えるスイッチ機構の解明が進めば、 そこに着目した切り替え促進薬の開発によりアレルギー治療が大きく進歩することが期待されます。
本研究は、 慶応大学、 順天堂大学、 日本大学、 カリフォルニア大学を含む多施設との共同研究成果であり、 この成果を報告した論文は、
2020年12月10日(日本時間)発行の米国学術誌Mucosal Immunology誌オンライン版にて発表されます。 * 研究の背景
図1:アレルギー反応が起こる仕組み
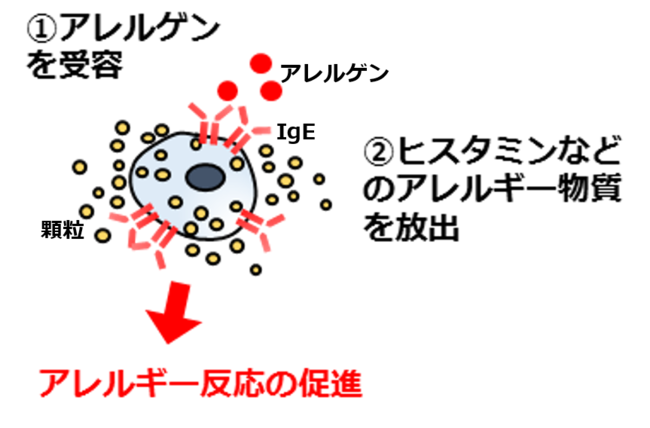
図1:アレルギー反応が起こる仕組み
食物アレルギーは日本で約120万人の患者がいるとされており、 かゆみやじんましん、 おう吐、 下痢の他、
最悪の場合ショックを起こして死に至るケースもある疾患で、 白血球の一種であるマスト細胞がアレルゲンを受容し、
ヒスタミンなどのアレルギー物質を放出することで発症します(図1)。
本研究では、 食物アレルギーの有望な治療法である経口免疫療法に着目しました。 この治療法はいわば「研究段階」であり、
どのような作用機序でアレルギーの根治につながっているのかについての情報は多くありません。 また、 治療中の副反応や成功率の低さも課題となっています。
これまで、 経口免疫療法を行うことで、
ヒスタミンを産生しアレルギーを発症させるマスト細胞の低応答化(注3)とアレルギーの抑制細胞である制御性T細胞(注4)が増えるという2つの現象は知られていましたが、
治療の中でマスト細胞の低応答化と制御性T細胞の増加がどのように関連しているのかは不明でした。 * 研究成果
図2:本研究によって明らかになった経口免疫療法のメカニズム。
アレルギーを引き起こす悪玉マスト細胞が、
アレルギーを抑制する善玉マスト細胞に変化する。
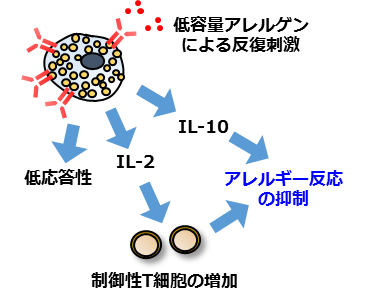
図2:本研究によって明らかになった経口免疫療法のメカニズム。 アレルギーを引き起こす悪玉マスト細胞が、 アレルギーを抑制する善玉マスト細胞に変化する。
本研究グループは、 独自に食物アレルギーの経口免疫治療モデルマウスを作り、 実験を行いました。
その結果、 経口免疫療法を行いアレルギー症状が軽減された群では、 マスト細胞は低応答の状態になるだけでなく、
アレルギーを抑制する制御性T細胞を増やすタンパク(IL-2)や、 アレルギー症状を抑えるタンパク(IL-10)を産生し、
アレルギーを起こす悪玉細胞からアレルギー反応を抑える善玉細胞へとその性質が変化していることを発見しました(図2)。 また、
食物アレルギーの経口免疫治療の途中にマスト細胞をマウスの体から除去したところ、
制御性T細胞が減少すると同時に制御性T細胞のアレルギーを抑える性質も低下していることが明らかになりました。
さらに、 経口免疫療法を試験管内で模倣したところ、 アレルギーの抑制物質を放出するように変化した善玉マスト細胞の作製に成功しました。
つまり、 経口免疫療法によるアレルギー治療の成功には、 アレルギーを起こすマスト細胞がアレルギー物質を放出させないように低応答化するだけではなく、
マスト細胞自身がアレルギーを抑える細胞へと機能を転換させるメカニズムが重要であることがわかりました。 * 今後の展望
本研究の成果により、 不明な点が多かった経口免疫療法を成功させるカギの一つが明らかになりました。 今後は、
アレルギーの悪玉細胞を善玉細胞へと効率的に切り替えるスイッチ機構が明らかになれば、 それを応用した切り替え促進薬の開発が期待されます。 さらには、
スイッチ機構を制御し悪玉細胞から善玉細胞への切り替えを安定して行えるようにすることで、 食物アレルギー治療の精度向上に貢献できると考えます。 * 用語解説
(注1)経口免疫療法:食物アレルギーの治療法であり、 アレルゲンとなる原因食物を連日食べることで、 耐性(免疫寛容)を獲得する治療法である。
研究段階の治療法である。
(注2)マスト細胞:免疫細胞の1つで、 肥満細胞とも呼ばれ、 細胞内にヒスタミンを含んだ多くの顆粒を持つ細胞である。 粘膜組織や結合組織に散在しており、
アレルゲン刺激によるマスト細胞の脱顆粒反応は、 アレルギー反応の原因であることが知られている。
(注3)低応答化:アレルゲンに対して活性化(脱顆粒)をしない状態、 脱感作状態をいう。
マスト細胞の低応答化をいかに長期的に維持するかがアレルギー治療の課題である。
(注4)制御性T細胞:アレルギーや自己免疫反応など様々な免疫応答を抑制することにより免疫疾患の発症を防ぐ重要な細胞である。 * 研究プロジェクトについて
本研究は文部科学省卓越研究員事業制度、 国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-PRIME)、
日本学術振興会科学研究費助成事業 (倉島洋介、 清野宏)、 公益財団法人ニッポンハム食の未来財団公募型研究助成事業、
公益財団法人持田記念医学薬学振興財団研究助成事業、 GSK ジャパン研究助成の一環で行われました。





ディスカッション
コメント一覧
まだ、コメントがありません