双極性障害患者神経細胞におけるDNAメチル化変化とその特性を解明
熊本大学大学院生命科学研究部の文東美紀准教授、 上田順子大学院生、 岩本和也教授、 順天堂大学大学院医学研究科の加藤忠史教授、 理化学研究所、
東京大学の共同研究グループは、 双極性障害患者前頭葉における遺伝子転写制御領域のDNAメチル化状態を明らかにしました。 (ポイント) *
双極性障害(躁うつ病)患者の前頭葉神経細胞におけるDNAメチル化※1状態を明らかにしました。
*
遺伝子転写制御領域※2の全体的な低メチル化と共に、 神経機能に重要な遺伝子では高メチル化していることを見出しました。
* DNAメチル化変化は、
双極性障害との遺伝学的関連が報告されているゲノム領域に集積していることを見出しました。
(概要説明)
熊本大学大学院生命科学研究部の文東美紀准教授、 上田順子大学院生、 岩本和也教授、 順天堂大学大学院医学研究科の加藤忠史教授、 理化学研究所、
東京大学の共同研究グループは、 双極性障害患者前頭葉における遺伝子転写制御領域のDNAメチル化状態を明らかにしました。
DNAメチル化は「エピジェネティクス」※3における主要な分子メカニズムであり、 遺伝子の働きを変化させることにより様々な疾患に関係していると考えられています。
研究グループは、 米国スタンレー財団※4より提供を受けた前頭葉死後脳試料を用い、 神経細胞核分画※5を行った上で網羅的なDNAメチル化解析を行いました。
その結果、 患者では多くの遺伝子が低メチル化状態にある一方、 精神・神経機能に重要な遺伝子は高メチル化されていることを明らかにしました。
DNAメチル化状態に変化のあった領域は、 双極性障害との遺伝学的関連が報告されているゲノム領域に有意に集積しており、 遺伝要因との関連が認められました。
本成果により、 双極性障害の病態に関する理解が進み、 エピジェネティックな状態を標的とした治療薬の開発が期待されます。
本研究成果は、 令和3年4月20日付(英国時間)の医学雑誌「Molecular Psychiatry」において公開されます。
(説明)
[背景]
双極性障害(躁うつ病)は、 人口の約1%が罹患し長期間の治療が必要とされる精神疾患です。 疫学研究などから、
発症には遺伝と環境要因の複雑な相互作用が関係していると考えられています。 一方、 環境要因によりゲノム中のDNAメチル化状態が変動し、
遺伝子の働きが変化する現象が「エピジェネティクス」として知られており、 精神疾患を含む様々な疾患の病態に深く関与すると考えられています。
これまでの研究では、 末梢血や唾液試料を用いたDNAメチル化解析が行われており、
DNAメチル化が変化した遺伝子の同定やバイオマーカーとしての利用が進められていますが、 精神疾患は脳神経系の疾患であることから、
脳組織を用いた研究が特に重要であると考えられます。 しかし脳組織は、 試料の希少性に加え、 神経細胞やグリア細胞など様々な細胞種が混在しており、
組織に含まれる細胞種の比率の違いの影響を受けるなど、 正確な解析は困難でした。
本研究グループは、 米国スタンレー財団より提供を受けた多数例の死後脳試料を用い、 神経細胞を選り分ける神経細胞核単離を行ったのち、
網羅的なDNAメチル化解析を行いました。
[研究の内容及び成果]
双極性障害患者34例、 健常者35例について、 前頭葉試料から神経細胞核マーカーを利用し、 神経細胞核と非神経細胞核に分画後、
それぞれから抽出したゲノムDNAを用いて遺伝子転写制御領域のDNAメチル化状態をアレイ法により調べました。 その結果、 神経細胞、
非神経細胞共に健常者と比べて、 双極性障害患者では多くの遺伝子が低メチル化状態にあることを見出しました。 また一方で、 精神・神経機能に重要な遺伝子では、
神経細胞において高メチル化状態にあることを明らかにしました(図1)。
次に、 双極性障害の治療薬である気分安定薬の影響を調べるため、 有効血中濃度域の気分安定薬(リチウム、 バルプロ酸、
カルバマゼピン)存在下でヒト神経系細胞株の培養を行い、 DNAメチル化状態を測定したところ、
双極性障害患者でDNAメチル化状態が変化した領域の約30%と重複が認められました。 DNAメチル化変化の方向は死後脳での変化方向と逆方向を示すものが多く、
治療効果を反映しているものと考えられました。
また、 DNAメチル化変化に関連する10種の遺伝子の発現量を測定したところ、 DNAメチル化酵素であるDNMT3B遺伝子が双極性障害患者で上昇しており、
神経細胞特異的なDNAメチル化変化と関連している可能性が考えられました。
最後に、 ゲノムワイド関連解析(GWAS)※6で同定された精神疾患に関連するゲノム領域とDNAメチル化状態が変化した領域を比較したところ、
双極性障害のGWASで報告されたゲノム領域に有意な集積が認められ、 うつ病や統合失調症で報告されたゲノム領域には集積は認められませんでした(図2)。
[今後の展開]
神経細胞に特異的なDNAメチル化変化とその特徴を明らかにしたことで、 双極性障害の病態の理解が大きく進むと期待されます。 また、
エピジェネティックな状態を標的とした治療薬の開発が期待されます。

図1:転写制御領域における低メチル化と神経機能に重要な遺伝子の高メチル化。
(左)高メチル化されたDNA領域の数が神経細胞・非神経細胞共に患者群(BD)で健常者群(CT)と比較し低下している。
(右)精神・神経機能に重要なBDNF受容体※7遺伝子(NTRK2)のメチル化状態。 患者で高メチル化されている領域を上段に、
患者・健常者それぞれのDNAメチル化状態を下段に示す。
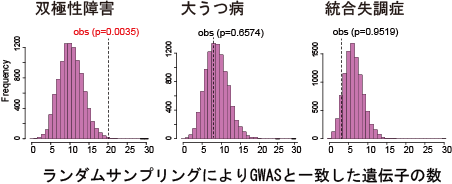
図2:神経細胞でDNAメチル化状態に差異が見られた遺伝子のGWAS領域への集積。 ゲノム中の遺伝子転写制御領域について、
DNAメチル化変動が認められた領域と同じ数を10,000回ランダムサンプリングを行い、 双極性障害、 大うつ病、 統合失調症のGWAS領域との一致数を調べ、
実測値(obs)のp値を求めた。 双極性障害のGWAS(Mullins et al., 2020で報告されたデータを使用)では有意な集積が認められた一方、
大うつ病(Howard et al., 2019のデータを使用)や統合失調症(Psychiatric Genomics Consortium,
2014のデータを使用)では有意な集積は認められなかった。
[用語解説]
※1 DNA メチル化
DNAの化学修飾の1つで、 シトシン塩基とグアニン塩基が連続しているCpG 配列と呼ばれる部位のシトシン塩基の炭素にメチル基(-CH3)が付加されている状態。
主に遺伝子の発現を抑制する方向に働く。 ある領域のCpG配列の多くにメチル化が生じている状態を高メチル化、 逆を低メチル化状態という。
環境要因の影響などを受け変動することが知られている。
※2 遺伝子転写制御領域
DNAにおける転写制御を担う領域であり、 プロモーター領域と呼ばれる。 遺伝子の働きのONとOFFや、 発現量の調節に関わる。
※3 エピジェネティクス
「遺伝子の塩基配列(設計図)の変化を伴わずに、 子孫や娘細胞に伝達される遺伝子発現調節機構」と定義される。
DNAメチル化やヒストン蛋白質修飾などが主要な分子メカニズムとして研究されている。
※4 スタンレー財団
精神疾患の基礎研究をサポートする米国の非営利団体。 活動の一環として患者から提供された死後脳組織を集積し、 研究目的として無償配布を行っている。
https://www.stanleyresearch.org/
※5 神経細胞核分画
神経細胞核には非神経細胞核にはないNeuNタンパク質が発現しているため、
NeuNタンパク質を標的とした蛍光標識抗体を用いて神経細胞核群だけを選り分ける(分画する)ことが可能。
※6 ゲノムワイド関連解析(GWAS)
患者集団と非患者集団とで統計学的に有意な頻度差を示す遺伝子多型を、 全ゲノム領域で網羅的に検索する遺伝子解析手法。 疾患と関連するゲノム領域を同定する手法。
※7 BDNF(brain-derived neurotrophic factor)
脳由来神経栄養因子。 神経細胞の生存や機能維持、 記憶、 学習など、 様々な局面で働く、 NTRK2(TrkB)を受容体とする分泌性蛋白質である。
BDNFの発現低下や機能不全が様々な精神・神経疾患で報告されている。




ディスカッション
コメント一覧
まだ、コメントがありません