アストラゼネカのカルケンス、治療歴を有する慢性リンパ性白血病の患者さんにおいて、イブルチニブと比較して心房細動の発現率を減少 加えて、初回治療として、4年時点においても患者さんのベネフィットを持続
加えて、初回治療として、4年時点においても患者さんのベネフィットを持続
本資料はアストラゼネカ英国本社が2021年6月7日に発信したプレスリリースを日本語に翻訳し、 みなさまのご参考に提供するものです。
本資料の正式言語は英語であり、 その内容・解釈については英語が優先します。
治療歴を有する患者さんを対象とした直接比較試験であるELEVATE-RR試験においてカルケンスはイブルチニブと比較して心血管系有害事象発現率が低く、
有害事象による中止が少なかった
ELEVATE-TN試験の長期追跡調査では、 カルケンスは初回治療として4年時点においても無増悪生存と良好な忍容性を維持していることを示した
アストラゼネカ(本社:英国ケンブリッジ、 最高経営責任者(CEO):パスカル・ソリオ[Pascal Soriot])は、
カルケンス(R)(一般名:アカラブルチニブ、 以下、 カルケンス)がイブルチニブとの直接比較試験である第III相ELEVATE-RR試験の最終結果から、
欧米において成人で最も一般的な種類の白血病である慢性リンパ性白血病(CLL)の治療歴を有する成人患者さんにおいて、 無増悪生存期間(PFS)の非劣性と、
心房細動の統計的に有意な減少を示したことを発表しました(1)。
加えて第III相ELEVATE-TN試験における4年時点での追跡調査結果から、 治療歴のないCLL患者さんを対象とした併用療法または単剤療法として、
カルケンスの強固なPFSのベネフィットが引き続き示されました。
ELEVATE-RR試験では、 追跡調査期間の中央値40.9カ月時点で、 主要評価項目であるPFにおいてイブルチニブに対する非劣性を達成し、
PFS中央値は両群ともに38.4カ月でした(ハザード比[HR]1.0、 95%信頼区間[CI]0.79-1.27)。 カルケンスを投与した患者さんでは、
イブルチニブを投与した患者さんと比較して、
主要な副次評価項目である全グレードの心房細動の発現率が統計的に有意に低いことが示されました(16.0%に対し9.4%)(2)。
オハイオ州立大学の特別栄誉教授であり、 ELEVATE-RR試験の治験責任医師でもあるJohn C. Byrd医学博士は次のように述べています。
「心臓の有害事象は、 重大な病的状態を引き起こし、 治療中止に繋がる可能性もあるため、
ブルトン型チロシンキナーゼ阻害剤による慢性リンパ性白血病患者さんの治療において重要な考慮事項となります。 これらのデータは、
カルケンスが忍容性の良好な治療選択肢であり、 心血管系毒性が低く、 有害事象による中止が全体的に少なかったことを示す説得力のあるエビデンスとなります。
医師にとって本剤を処方する際には、 患者さんの病気をコントロールしながら治療を継続できているという自信にもつながります」。
オンコロジー事業部門のエグゼクティブバイスプレジデントであるDave Fredricksonは次のように述べています。 「忍容性は、
長年にわたり薬物療法を続け、 複数の併存疾患を経験することが多い慢性リンパ性白血病患者さんの治療において重要な因子です。
ASCOで発表された両試験の40カ月間におよぶ追跡調査であるカルケンスの包括的なデータ評価により、
この治療薬における良好なリスク・ベネフィットに関する信頼が確立されました。 また、 これらの結果は、 この深刻な慢性疾患とともに生きる人々にとって、
カルケンスが望ましい選択肢であるという強固なエビデンスであると言えます」。
両試験の結果は、 2021年6月7日に開催された2021年米国臨床腫瘍学会(ASCO)年次総会において発表されました。
ELEVATE-RR:再発または難治性CLLにおけるカルケンスとイブルチニブの比較
ELEVATE-RR(ACE-CL-006)試験は、 治療歴を有する17p欠失または11q欠失が認められたCLL患者さんを対象に、
2種類のブルトン型チロシンキナーゼ(BTK)阻害剤を比較する初めての第III相試験です(2)。 本試験では、
治療歴のある高リスク予後因子を有するCLL患者さんを対象に、 カルケンス(n=268)とイブルチニブ(n=265)を比較する試験であり、
主要評価項目として設定されたPFSの非劣性を達成しました(2)。
カルケンス投与群は、 イブルチニブ投与群と比較して、
主要な副次評価項目である全グレードの心房細動の発現率が統計的に有意に低いことが示されました(16.0%[n=42/263]に対し9.4%[n=25/266];p=0.02)(2)。
有害事象により治療中止に至ったのは、 カルケンス投与群で14.7%だったのに対し、 イブルチニブ投与群では21.3%でした。
カルケンスとイブルチニブとの比較において臨床的に注目すべき有害事象には、 心血管イベント(全グレード、 それぞれ24.1%と30.0%)、
出血性イベント(全グレード、 それぞれ38.0%と51.3%)、 高血圧(全グレード、 それぞれ9.4%と23.2%)、 感染症(全グレード、
それぞれ78.2%と81.4%)、 間質性肺疾患/肺炎(全グレード、
それぞれ2.6%と6.5%)および悪性黒色腫以外の皮膚がんを除く治療関連二次性悪性腫瘍(全グレード、 それぞれ9.0%と7.6%)などがありました(2)。
重篤な有害事象(全グレード)は、 カルケンス投与群で53.8%、 イブルチニブ投与群では58.6%で発現しました(2)。
全生存期間(OS)中央値はいずれの投与群も未到達で、
カルケンス投与群63例(23.5%)およびイブルチニブ投与群73例(27.5%)にイベントが発現しました(HR 0.82、 95% CI
0.59-1.15)(2)。 ELEVATE-RRで示されたカルケンスの安全性および忍容性は、 カルケンスの既知のプロファイルと一致していました。
ELEVATE-TN:治療歴のないCLL患者さんを対象としたカルケンスの4年間の追跡調査
ELEVATE-TN(ACE-CL-007)試験は、 前治療歴のないCLL患者さんを対象に、 カルケンスとオビヌツズマブの併用療法またはカルケンスの単剤療法を、
chlorambucilとオビヌツズマブの併用療法と比較し、 安全性と有効性を評価した、 無作為化多施設共同非盲検第III相試験です(3)。 本試験では、
追跡調査期間の中央値28.3カ月後の中間解析のデータカットオフ時点で、
主要評価項目(カルケンスとオビヌツズマブの併用療法およびchlorambucilとオビヌツズマブの併用療法を比較したIRC評価に基づくPFS)を達成しました(4)。
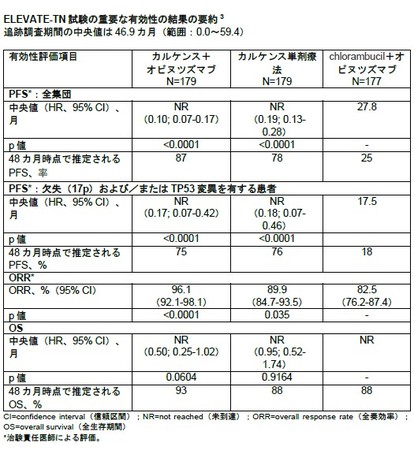
追跡調査期間の中央値46.9カ月後、 第III相ELEVATE-TN試験では、 chlorambucilとオビヌツズマブの併用療法と比較して、
カルケンスとオビヌツズマブの併用療法が病勢進行または死亡のリスクを90%低下させ(HR 0.10, 95% CI 0.07-0.17)、
カルケンスの単剤療法では81%低下させた(HR 0.19, 95% CI 0.13-0.28)ことが示されました(3)。
カルケンスとオビヌツズマブの併用療法またはカルケンスの単剤療法では、 48カ月時点で推定されるPFS率はそれぞれ87%と78%であったのに対し、
chlorambucilとオビヌツズマブの併用療法では25%でした(3)。 PFSの結果は高リスクのサブグループ間で一貫していました(3)。
追跡調査の4年時点で、 どちらのカルケンス投与群でもPFSの中央値にはまだ達していませんでした。 いずれの投与群でもOSの中央値は未到達で、
カルケンスとオビヌツズマブ投与群で有意ではないものの良好な傾向が認められました(p=0.0604)(3)。
安全性プロファイルは24カ月時点の中間解析時から概ね変化せず、 投与中止率はどの投与群でも同程度でした(カルケンス+オビヌツズマブ、
カルケンス単剤療法およびchlorambucil+オビヌツズマブでそれぞれ25.1%、 30.7%および22.6%)(3)。 最も多かった投与中止理由は、
有害事象(それぞれ12.8%、 12.34%および14.7%)および病勢進行(それぞれ4.5%、 7.8%および1.7%)でした(3)。
カルケンス併用療法(n=178)、
カルケンス単剤療法(n=179)およびchlorambucilとオビヌツズマブの併用療法(n=169)で認められている注目すべき有害事象は、 グレードを問わず、
心臓事象(それぞれ20.8%、 19.0%および7.7%)、 出血(それぞれ47.2%、 41.9%および11.8%)、 高血圧(それぞれ7.9%、
7.3%および4.1%)、 感染症(それぞれ75.3%、 73.7%および44.4%)および二次性悪性腫瘍(それぞれ15.7%、
13.4%および4.1%)などでした(3)。
※カルケンスのCLLに対する初回治療は本邦未承認です。
以上
*****
慢性リンパ性白血病(CLL)について
CLLは成人白血病において欧米では最も患者数が多く、 2017年には世界で新たに114,000例が診断されており、
治療の発展による生存期間の伸長に伴い患者数は増加するとみられています(1,5-7)。 CLLでは、 骨髄中の造血幹細胞が過剰に異常なリンパ球となり、
これらの異常細胞は、 感染症に対する防御力が低いことが知られています。 異常細胞数が増えるに従い、 健全な白血球、 赤血球および血小板が減少するため、 貧血、
感染および出血を引き起こす可能性があります(5)。 BTKを介するB細胞受容体のシグナル伝達は、 CLLの基本的な増殖経路の一つです。
ELEVATE-RR試験について
ELEVATE-RR(ACE-CL-006)試験は、 少なくとも一度の治療歴を有する再発または難治性のCLL患者さんで、
以下の予後因子(17p欠失または11q欠失、 あるいはその両方の欠失が認められる場合)を伴うCLL患者さんを対象に、
カルケンスとイブルチニブを比較する無作為化多施設共同非盲検第III相非劣性試験です。 本試験では、
533例の患者さんを1対1の比率で2群に無作為割付けしました。 1群目の患者さんには、
病勢進行または許容できない毒性が発現するまでカルケンス(100mg)を1日2回経口投与しました。 これに対して2群目の患者さんには、
病勢進行または許容できない毒性が発現するまでイブルチニブ(420mg)を1日1回経口投与しました(2)。
本試験の主要評価項目は、 独立判定委員会が評価したPFSとし、 250件のイベント発現後に、 HRの上限を<1.429として、
PFSの非劣性を検討しました(2)。 副次評価項目には、 心房細動の発現率、 試験治療下で発現したグレード3以上の感染症の発現率、
リヒター形質転換(CLLが悪性度の高いリンパ腫に変化する病態)の発現率および全生存期間を含めました(2,8)。 心房細動は心拍が不規則な状態であり、 脳卒中、
心不全およびその他の心臓関連合併症のリスクを高める可能性があります(9)。
ELEVATE-TN試験について
ELEVATE-TN(ACE-CL-007)試験は、 未治療のCLL患者さんを対象に、 カルケンスの単剤療法またはカルケンスとオビヌツズマブの併用療法を、
chlorambucilとオビヌツズマブの併用療法と比較し、 有効性と安全性を評価した無作為化多施設共同非盲検第III相試験です。 本試験では、
535例を1対1対1で3群に無作為割付けしました。 1群目の患者さんにはchlorambucilとオビヌツズマブの併用療法、
2群目にはオビヌツズマブとカルケンス(病勢進行が発現するまで100mgを1日2回投与)の併用療法、
3群目にはカルケンス単剤療法(病勢進行または許容できない毒性が現れるまで約12時間ごとに100mgを投与)を行いました(3)。
主要評価項目は、 chlorambucilとオビヌツズマブの併用療法と比較したカルケンスとオビヌツズマブの併用療法の無増悪生存期間(PFS)で、
独立判定委員会(IRC)によって評価されました。 副次評価項目はchlorambucilとオビヌツズマブの併用療法と比較したカルケンス単剤療法のPFSで、
IRCによって評価されました。 他の副次評価項目は、 客観的奏効率、 次治療までの期間、 全生存期間および治験責任医師が評価したPFSでした(3)。
中間解析後の評価は、 治験責任医師のみによって行われました(3)。
第III相ELEVATE-TN試験の初期成績は、 2019年12月に開催された米国血液学会年次総会で発表されました(10)。 この結果は、
再発または難治性CLLを対象とした第III相ASCEND試験で既に報告されているデータに加え、
CLLまたは小リンパ球性リンパ腫(SLL)の成人患者さんの治療薬として米国FDAおよびオーストラリア薬品・医薬品行政局からの、
またCLLの治療薬としてEUおよびカナダ保健省からの、 カルケンスの承認を裏付けるデータでした。
カルケンスについて
カルケンス(アカラブルチニブ)は、 次世代の選択的ブルトン型チロシンキナーゼ(BTK)阻害剤です。
カルケンスはBTKに共有結合することでその阻害作用を発揮します(11,12)。 B細胞内においてBTKシグナル伝達は、 B細胞の増殖、 輸送、 走化、
および接着に必要な情報伝達系の活性化を引き起こすことが知られています(11)。
カルケンスは米国でCLLおよびSLLの治療薬として、 EUをはじめとする複数の国々でCLLの治療薬として、
日本では再発または難治性のCLL(SLLを含む)の治療薬として承認されています。 また、 日本ではCLLの一次治療薬として第I相試験も実施しています。
米国をはじめ複数の国々では、 カルケンスは、 1種類以上の治療歴を有するマントル細胞リンパ腫(MCL)の成人患者さんの治療薬としても承認されています。
米国でのMCLに対する適応は、 全奏効率に基づいた迅速承認を受けました。 本適応症に対する継続的な承認は、
検証的試験による臨床的ベネフィットの検証および説明が条件となる可能性があります。 現時点では、
カルケンスは欧州および日本ではMCLの治療薬として承認されていません。
広範な臨床開発プログラムの一環として、 現在、 アストラゼネカとAcerta Pharmaでは、 カルケンスについて、 20を超える臨床試験を実施しています。
カルケンスは、 CLL、 MCL、 びまん性大細胞型B細胞リンパ腫、 原発性マクログロブリン血症、 濾胞性リンパ腫、
およびその他の血液悪性腫瘍を含む複数のB細胞性の血液がんの治療薬として評価中です。
アストラゼネカにおける血液領域について
アストラゼネカは、 血液領域における治療を再定義するため、 サイエンスの限界に挑戦しています。 血液腫瘍への深い理解と固形がんにおける強みを活かし、
6つの科学的基盤で疾患の根本的な原因を標的として新しい治療法の開発を推進しています。 アンメットメディカルニーズの高い血液腫瘍への取り組みにより、
患者さんや介護者の方々に有意義な影響を与える革新的な医薬品と医療サービスへのアプローチを提供し、 血液腫瘍の治療経験を変革することを目指しています。
アストラゼネカにおけるオンコロジー領域について
アストラゼネカは、 あらゆる種類のがんに対して治療法を提供するという高い目標を掲げ、 がんとその発見にいたるまでの複雑さを科学に基づいて理解し、
患者さんの人生を変革する医薬品の開発および提供を通じて、 オンコロジー領域の変革をけん引していきます。
アストラゼネカは治療困難ながん種に注力しています。 当社は持続的なイノベーションにより、 医療活動および患者さんの医療経験を一変させる可能性のある、
製薬業界でもっとも多様なポートフォリオと開発パイプラインを構築しています。
アストラゼネカはがん治療のパラダイムを再定義し、 将来的にはがんによる死亡をなくすことをビジョンに掲げています。
アストラゼネカについて
アストラゼネカは、 サイエンス志向のグローバルなバイオ・医薬品企業であり、 オンコロジーおよび循環器・腎・代謝疾患、
呼吸器・免疫疾患からなるバイオ・医薬品において、 医療用医薬品の創薬、 開発、 製造およびマーケティング・営業活動に従事しています。
英国ケンブリッジを本拠地として、 当社は100カ国以上で事業を展開しており、 その革新的な医薬品は世界中で多くの患者さんに使用されています。 詳細については
https://www.astrazeneca.comまたは、 ツイッター@AstraZeneca
(
https://twitter.com/AstraZeneca
)(英語のみ)をフォローしてご覧ください。

プレスリリースは以下よりダウンロードできます。
https://prtimes.jp/a/?f=c-24308-2021061412-3916e9bfb5c3888258bde52a8547547a.pdf


ディスカッション
コメント一覧
まだ、コメントがありません