ユーグレナおよびその成分であるパラミロンの胃がんモデルマウスの初期病変に対する効果
角田茂准教授らと株式会社ユーグレナ(本社:東京都港区、 代表取締役社長:出雲 充)は、 共同研究により、 微細藻類ユーグレナの乾燥粉末が、
将来胃がんに進展すると予想される胃粘膜の炎症を抑制することを示唆する研究成果を確認しました。 1.発表者:
飯田 理聖(東京大学農学部獣医学専修:研究当時)
Mark Joseph M. Desamero
(東京大学大学院農学生命科学研究科獣医学専攻 博士課程:研究当時/
現:フィリピン大学ロスバニョス校獣医学部 准教授)
安田 光佑(株式会社ユーグレナ研究開発部機能性研究課)
中島 綾香(株式会社ユーグレナ研究開発部機能性研究課 課長)
角田 茂(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
平山 和宏(東京大学大学院農学生命科学研究科獣医学専攻 教授)
2.発表のポイント:
◆微細藻類であるユーグレナ(注1)の乾燥粉末を、 胃がんを自然発症する遺伝子改変モデルマウスに投与し、 その効果を検討しました。
◆ユーグレナは将来胃がんに進展すると予想される胃粘膜の炎症を抑制することができました。 また、 転移や悪性化に関連する遺伝子の発現も抑えられました。
◆今回の研究は胃がんそのものを抑制するかどうかを観察したものではありませんが、 ユーグレナの摂取によりがんの発生や進展を遅らせることができれば、
がん患者の生存率を向上させられると期待されます。
3.発表概要:
東京大学大学院農学生命科学研究科獣医学専攻の平山和宏教授、 角田茂准教授らは、 株式会社ユーグレナなどとの共同研究で、A4gnt
遺伝子欠損マウス(注2)という胃がんを自然発症する疾病モデルマウス(以下「胃がんモデルマウス」)を用いて、
ユーグレナの経口摂取が胃がんの初期過程に及ぼす影響について検討しました。
3週間にわたるユーグレナの投与で、 正常なマウスに比べて胃がんモデルマウスの胃粘膜で顕著に増加する炎症細胞の数が有意に減少しました。
発現が異常に亢進することが知られているサイトカインやケモカイン(注3)などの遺伝子発現も抑制しました。
胃粘膜の異形成や細胞の増殖には明らかな効果を示しませんでした。
本研究は、 胃がんモデルマウスの初期病変に対するユーグレナの効果を明らかにしたもので、 胃がんの発生を直接観察したものではありませんが、
胃粘膜の炎症を抑制することで将来の胃がんの発症を抑えることができる可能性を示唆しています。
胃がん患者の生存率はいかに早期にがんを発見できるかに大きくよっていますので、 胃がんの発生や進行を遅らせることができれば、
胃がんによる死亡をさらに減らすことができると期待できます。
4.発表内容:
胃がんは世界的には2番目に多いがんであり、 日本では年間約129,000人に発生し、 約43,000人の死亡原因となっています(
https://ganjoho.jp/reg_stat/statistics/stat/summary.html)。
今では胃がんは必ずしも死に直結する病ではなくなってはいますが、 その生存率はいかに早期にがんを発見できるかに大きくよっています。 従って、
胃がんの発生や進行を遅らせることができれば、 胃がんによる死亡をさらに減らすことができると期待できます。
そこで平山教授らは、 株式会社ユーグレナなどとの共同研究で、A4gnt
遺伝子欠損マウスという胃がんを自然発症する疾病モデルマウス(以下「胃がんモデルマウス」)を用いて、
ユーグレナまたはユーグレナの成分のひとつであるパラミロンという物質の経口投与が胃がんの初期過程に及ぼす効果について検討しました。 本研究では、
雄および雌の10週齢の胃がんモデルマウスにユーグレナまたはパラミロンを3週間毎日投与して、 その効果を観察しました。 このモデルマウスの胃がんは
「慢性的な炎症による胃粘膜の増殖亢進(過形成)→異常な細胞の増殖(異形成)→がん」
というヒトの胃がんによく見られる過程と同じ進行をするのが特徴ですが、 今回の研究で用いた10~13週齢では、
初期病変である胃粘膜の異形成が見られる前がんステージです。
3週間にわたるユーグレナまたはパラミロンの投与で、
正常なマウスに比べて胃がんモデルマウスの胃粘膜で顕著に増加するCD3陽性Tリンパ細胞という炎症にかかわる細胞の数が有意に減っているのが観察されました。
同じく炎症にかかわる多形核白血球にも減少する傾向が見られました。 さらに、
胃がんモデルマウスの胃粘膜で発現が異常に亢進することが知られているサイトカインやケモカインなどの遺伝子解析を行ったところ、
ユーグレナの投与は胃粘膜上皮細胞の増殖を促進するサイトカインであるIL-11と炎症を促進させがん細胞の転移や浸潤の能力を高めるケモカインであるCxcl1の遺伝子の発現を抑制しました。
残念ながら組織学的には、 胃粘膜の異形成や細胞の増殖に明らかな効果を示しませんでした。
一方、 パラミロンを投与した胃がんモデルマウスでは、 胃粘膜のCD3陽性Tリンパ細胞を減少させ、
IL-11と炎症にかかわるケモカインであるCcl2の遺伝子発現を抑制しましたが、 その効果はユーグレナの投与ほど顕著ではありませんでした。 このことは、
ユーグレナの炎症を抑制する効果はパラミロンだけでなく、 ユーグレナに含まれるさまざまな成分も重要な役割を持っていることを示唆しています。
また、 ユーグレナの投与は胃がんモデルマウスの小腸内のIgA(免疫グロブリンA)(注4)の産生を促進しました。
本研究は、 胃がんモデルマウスの初期病変に対するユーグレナの効果を検討したもので、 胃がんの発生を直接観察したものではありませんが、
ユーグレナの摂取が胃粘膜の炎症を抑制することで、 将来の胃がんの発症を抑えることができる可能性を示唆しています。 今後、
胃がんが発症するまで長期に効果を観察する実験により、 ユーグレナの抗がん効果が明らかにされることが望まれます。
【謝辞】
本研究の一部は、 JSPS科研費23114504およびJSPS科研費25670191の助成を受けたものです。
【研究チームの構成】
飯田 理聖(東京大学農学部獣医学専修:研究当時)
Mark Joseph M. Desamero
(東京大学大学院農学生命科学研究科獣医学専攻 博士課程:研究当時/
現:フィリピン大学ロスバニョス校獣医学部 准教授)
安田 光佑(株式会社ユーグレナ研究開発部機能性研究課)
中島 綾香(株式会社ユーグレナ研究開発部機能性研究課 課長)
鈴木 健吾(株式会社ユーグレナ執行役員 研究開発担当)
チェンバーズ ジェームズ(東京大学大学院農学生命科学研究科獣医学専攻 助教)
内田 和幸(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
小川 諒平(東京大学大学院農学生命科学研究科食の安全研究センター修士課程:研究当時)
八村 敏志(東京大学大学院農学生命科学研究科食の安全研究センター 准教授)
中山 淳(信州大学医学部 教授・医学部長)
久和 茂(東京大学大学院農学生命科学研究科獣医学専攻 教授)
三浦 こずえ(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
角田 茂(東京大学大学院農学生命科学研究科獣医学専攻 准教授)
平山 和宏(東京大学大学院農学生命科学研究科獣医学専攻 教授)
5.発表雑誌:
雑誌名:Scientific Reports
論文タイトル:Effects of orally administered Euglena gracilisand its reserve
polysaccharide, paramylon, on gastric dysplasia in A4gntknockout mice
著者:Masataka Iida, Mark Joseph Desamero, Kosuke Yasuda, Ayaka Nakashima, Kengo
Suzuki, James Ken Chambers, Kazuyuki Uchida, Ryohei Ogawa, Satoshi Hachimura,
Jun Nakayama, Shigeru Kyuwa, Kozue Miura, Shigeru Kakuta*, Kazuhiro Hirayama*
DOI番号:10.1038/s41598-021-92013-5
6.問い合わせ先:
東京大学大学院農学生命科学研究科 獣医学専攻 獣医公衆衛生学研究室
東京大学大学院農学生命科学研究科 獣医学専攻 実験動物学研究室
株式会社ユーグレナ コーポレートコミュニケーション課
7.用語解説:
注1 ユーグレナ
ユーグレナは動物と植物の両方の性質を持つ微細藻類で、 その健康効果のために食品やサプリメントとして広く利用されています。 これまでに、
ユーグレナが腸内細菌叢のバランスを調整して免疫バランスを調整する可能性(
https://www.euglena.jp/news/20210115-2/)、 免疫を介して肺がんの増殖を抑制する可能性(
https://www.euglena.jp/news/200512-2/
)などが報告されています。
注2A4gnt遺伝子欠損マウス
A4gnt遺伝子欠損マウスは信州大学の中山淳教授らが開発した、 α1,4-N-アセチルグルコサミン転移酵素をコードするA4gnt
遺伝子を欠損した胃がんのモデルマウスです。 α1,4-N-アセチルグルコサミンは胃と十二指腸の粘膜に存在する糖鎖ですが、
ヒトの胃がんにおいて消失しているケースがあることが確認されており、 一部の胃がん患者ではその発現と予後が相関することが報告されています。A4gnt
遺伝子欠損マウスは、 胃粘膜のα1,4-N-アセチルグルコサミンを欠き、 加齢に伴い胃がんを自然発症します。
注3 サイトカイン、 ケモカイン
サイトカインやケモカインは生体内で免疫の情報伝達を担うたんぱく質で、 免疫細胞の活性化や機能抑制を担います。
注4 IgA
IgA(免疫グロブリンA)は、 腸管腔内や粘膜内に分泌されて、 腸内常在細菌の腸管粘膜上皮細胞への接触や侵入を防ぐことで、
腸管免疫系が過剰に刺激されないように調節していると考えられています。
8.添付資料:
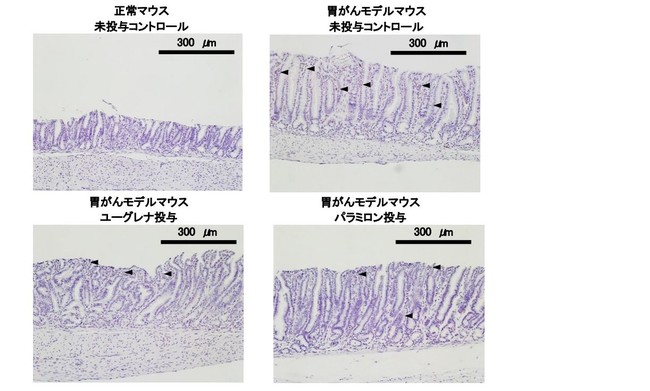
図1:胃粘膜のCD3陽性Tリンパ細胞(炎症性細胞)に対するユーグレナおよびパラミロンの影響
矢じりは、 粘膜の炎症に関わるCD3陽性Tリンパ細胞を示します。
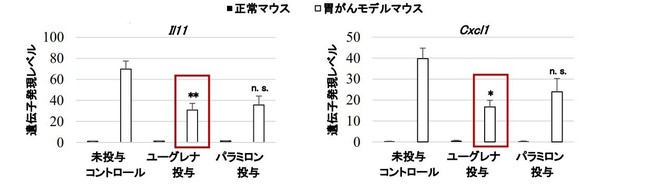
図2:胃がんの発症に関わるサイトカインやケモカインの遺伝子発現
胃がんモデルマウスにユーグレナもパラミロンも投与していない未投与コントロールに対して有意差あり(**p<0.01, *p<0.05, n.s.有意差なし)







ディスカッション
コメント一覧
まだ、コメントがありません