ルミラ・ダイアグノスティクス・ジャパン、新型コロナウイルス抗原検査薬ルミラ・SARS-CoV-2 Agテストストリップ保険適用のお知らせ
~小型の検査機器で、検体から12分以内に抗原を検出~ ルミラ・ダイアグノスティクス・ジャパン株式会社(本社:東京都新宿区、 代表取締役社長 加藤 啓介、
以下ルミラ・ダイアグノスティクス・ジャパン)は、 ルミラ・SARS-CoV-2 Agテストストリップ(以下、 「ルミラ・SARS-CoV-2
Agテスト」)が2021年1月19日に新型コロナウイルス感染症(COVID-19)抗原検査薬として製造販売承認を取得し、 同日1月19
日に保険適用されたことをお知らせします。 今後、 「ルミラ・SARS-CoV-2 Agテスト」は、 発売日を2月1日、
出荷開始日を2月5日とさせていただく予定です。
「ルミラ・SARS-CoV-2 Agテスト」は、 マイクロ流体免疫蛍光法を用い、
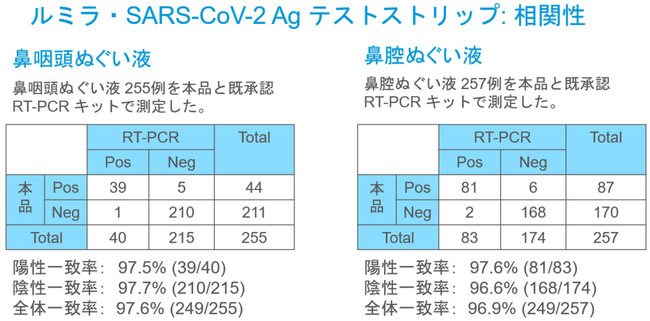
症状のある患者の鼻咽頭ぬぐい液又は鼻腔ぬぐい液に含まれる新型コロナウイルス感染症の原因ウイルスである SARS-CoV-2抗原を12分以内に検出します。
鼻腔ぬぐい液は、 鼻咽頭ぬぐい液に比べ患者への侵襲性が低く、 医師あるいは医療従事者の管理下での患者による自己採取も可能であるため、
医療従事者の暴露リスクの低減が期待できます。 また本検査薬に用いる専用測定 機器「ルミラ測定機器」は小型で持ち運び可能なため、
医療機関のみならず様々な場所での測定が可能になります。
ルミラ・ダイアグノスティクス・ジャパン代表取締役社長の加藤 啓介は、
「場所を問わずに約12分という短時間で新型コロナウイルス感染症の抗原を検出する「ルミラ・SARS-CoV-2 Agテスト」が、 製造販売承認を経て、
保険適用されたことを大変うれしく思います。 本製品により、 コロナウイルス抗原検査をより身近なものとし、
幅広く各医療機関でのSARS-CoV-2(新型コロナウイルス)抗原検出に貢献できることを確信しています。 」と述べております。
「ルミラ・SARS-CoV-2 Agテスト」は、 2020年8月18日に米食品医薬品局(FDA)から緊急使用許可(EUA)の承認を取得し、
2020年8月28日には欧州にてCEマークを取得しており、 既にアメリカ、 EU、 アフリカで販売されています。
ルミラ・ダイアグノスティクス・ジャパンは、 検査診断技術の向上を通じて、 新型コロナウイルスをはじめとする感染症対策や、 日常診療に貢献してまいります。


LumiraDxについて
LumiraDxは2014年に設立され、 革新的なポイントオブケア診断プラットフォームを開発、 製造、 販売している企業です。 医療従事者が世界中で入手し易く、
地域医療に貢献できるよう設計されたLumiraDxのプラットフォームは、 検査室の分析装置に匹敵する技術を統合し、 小型化することで、
医療現場で簡単に使用できるポイントオブケア機器として機能します。 一つのプラットフォームで幅広い項目を検査可能であり、 低コストで高品質な結果を保証し、
地域の医療インフラを構築するための理想的なリソースとなっています。 LumiraDxはスコットランドのスターリングを主要な研究開発(R&D)と製造拠点とし、
世界中の関連会社を通じて主要なマーケットにアクセスしています。 LumiraDxはビル&メリンダ・ゲイツ財団、 モーニングサイドベンチャーズ、
ボストンキャピタル株式会社などの機関・戦略投資家から、 約6億ドルの融資・出資を受けています。
日本法人概要
会社名: ルミラ・ダイアクノスティクス・ジャパン株式会社(LumiraDx製品 日本国内製造販売元)
設立日: 2018年10月11日
住 所: 〒160-0022 東京都新宿区新宿五丁目2番3号MRCビル6階
電 話: 03-6384-2302 Fax:03-6384-2374 フリーダイヤル:0120-632-860
Eメール: [email protected]
LumiraDxホームページ:
https://www.lumiradx.com/uk-en/
日本語ホームページ:
https://www.lumiradx.com/jp-ja/
プレスリリースは以下よりダウンロードできます。
https://prtimes.jp/a/?f=c-71186-2021011910-06961738e74878f17dcf7c7e351c774e.pdf



ディスカッション
コメント一覧
まだ、コメントがありません